


浏览次数:736
2023年7月21日,威尼斯wns·8885556(动物医学院)动物干细胞与重编程团队在国际著名期刊Cellular and Molecular Life Sciences在线发表了题为“WD Repeat Domain 82 (Wdr82) Facilitates Mouse iPSCs Generation by Interfering Mitochondrial Oxidative Phosphorylation and Glycolysis”的研究论文。已毕业硕士崔贵娜、在读硕士生周婧萱为该论文的第一作者,同济大学高绍荣教授和山东农业大学师科荣副教授为论文的通讯作者。
多能干细胞(PSCs)是一类具有自我更新和多向分化能力的细胞,主要分为胚胎干细胞(ESCs)和诱导多能干细胞(iPSCs)。其中,iPSCs因不需要胚胎供给而受生物伦理限制,在现代生物医学及现代动物育种(干细胞育种)等领域具用显著的应用优势。自2006年山中伸弥实验室获得iPSCs以来,iPS技术受到广泛关注。但是,目前iPS技术生产iPSCs存在诱导效率低的问题。提高体细胞重编程效率、生产功能正常的iPSCs具用重要的应用价值。
体细胞核移植(SCNT)技术中卵母细胞因子促进体细胞核完成重编程,这与iPSCs的形成过程类似,因而推测卵母细胞因子也可能在促进体细胞重编程形成iPSCs的过程中发挥重要调控作用。基于前期的研究基础,筛选了3个在卵母细胞MⅡ期高表达且与表观遗传修饰相关的细胞因子(Dpy30、Taf7和Wdr82)用于体细胞重编程,与经典的iPS技术(Yamanaka四因子产生iPSCs)相比,Wdr82可以显著促进体细胞重编程的效率。经验证所获得的iPSCs克隆不仅具用多能性、可完成体外三胚层分化,并且可获得嵌合体小鼠(图1)。该研究再次证明了卵母细胞因子可促进体细胞重编程为干细胞的作用,启动胚胎早期发育。同时,为体外高效生产iPSCs提供了新的方法与途径。
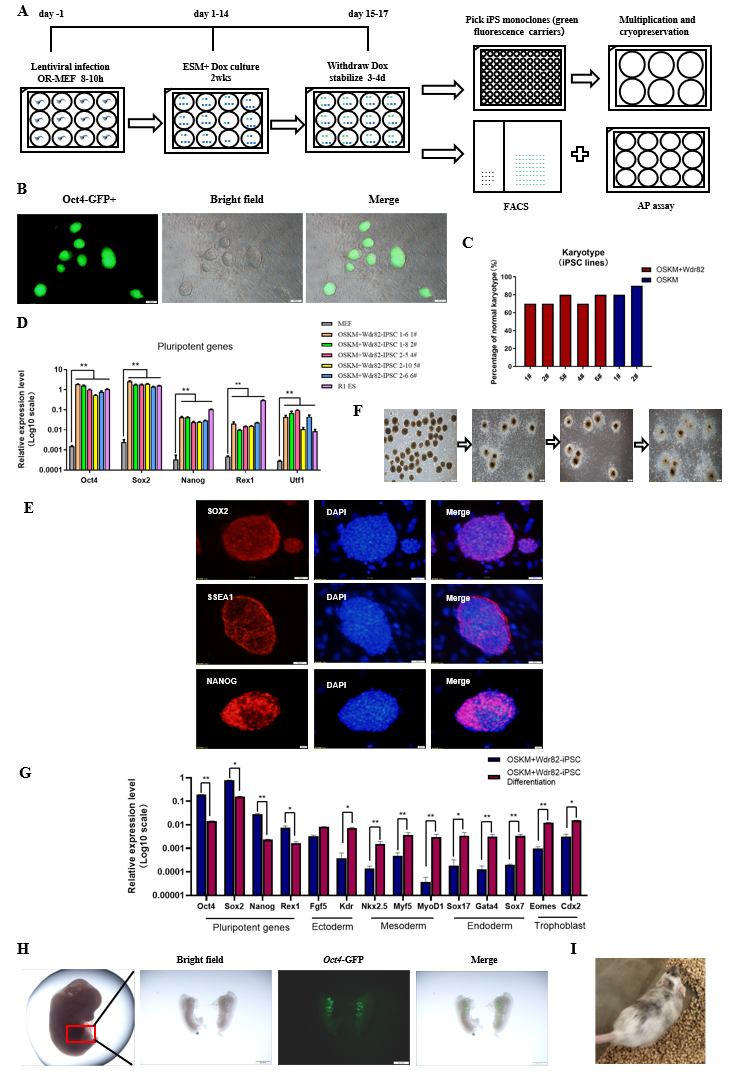
图1. 体细胞重编程形成的Wdr82+OSKM-iPSC克隆具有干细胞功能,可产生嵌合体小鼠
进一步研究,发现Wdr82促进体细胞重编程的同时伴随着细胞代谢途径的显著调节:Wdr82显著抑制细胞内的氧化磷酸化途径及糖酵解途径(图2)。Wdr82可参与组蛋白H3K4甲基化转移酶复合物Set1A/B的组装而调节染色质的H3K4me3水平,而且可调节复合物中RNA聚合酶活性调控下游基因的转录水平。
该研究解析了卵母细胞因子通过组蛋白甲基化修饰参与细胞代谢调节而促进体细胞重编程效率的机制,对于现代生物医学与现代动物育种具用重要的理论指导意义与应用价值。
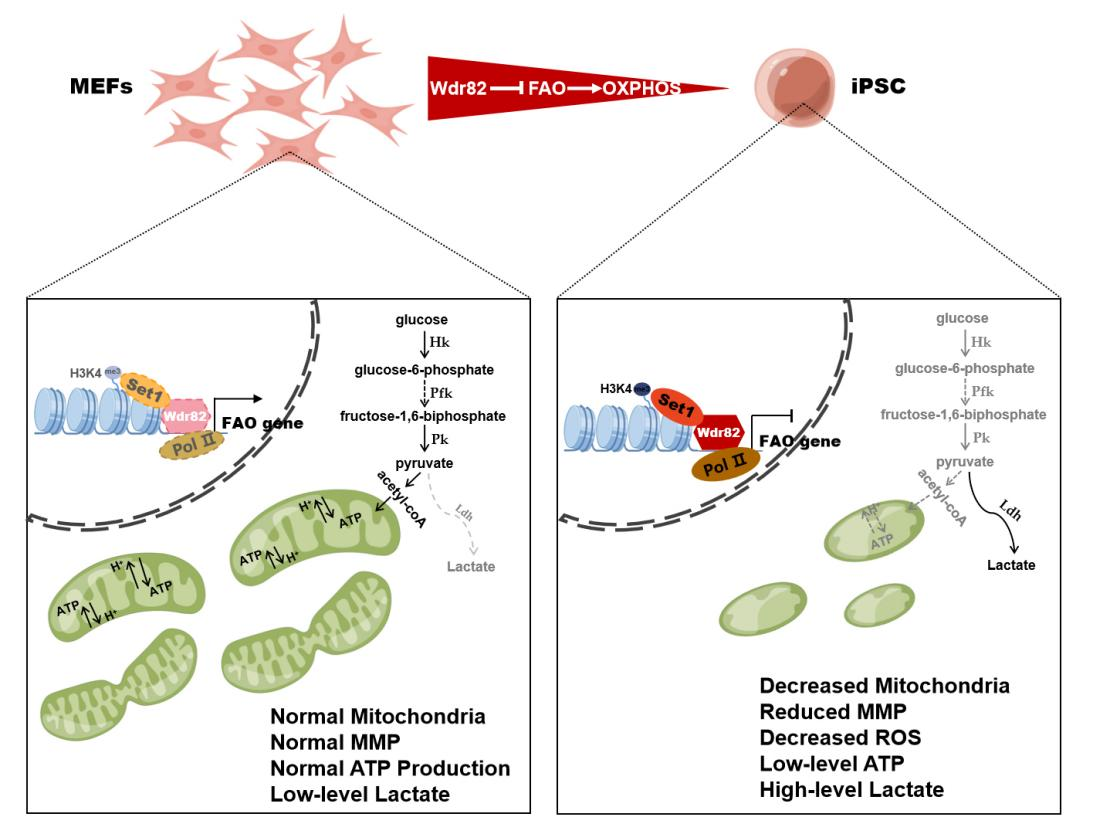
图2. Wdr82抑制细胞氧化磷酸化过程、促进体细胞重编程的工作模式图
该研究的嵌合体小鼠工作在同济大学“细胞干性与命运编辑前沿科学中心”完成,其余工作均在山东农业大学“动物干细胞与重编程”实验室完成。该研究先后得到了国家重点研发计划项目课题(2021YFD1200903-7和2021YFD1200404)、国家自然科学基金项目(31402054和31721003)、山东省农业良种工程项目(2019LZGC011,2016LZGC030)和山东省自然科学基金项目(ZR2020MC166和ZR2013CM013)的资助。
论文链接:https://doi.org/10.1007/s00018-023-04871-z